成獣心臓組織の心筋細胞、ヒトiPS分化心筋細胞における精密な遺伝子改変に成功
Adeno-associated Virus-mediated Gene Delivery Promotes S-phase Entry-independent Precise Targeted Integration in Cardiomyocytes
Scientific Reports 10, Article number: 15348 (2020)
https://www.nature.com/articles/s41598-020-72216-y
ゲノム編集によりDNA二重鎖が切断された後、正確な遺伝子改変を行う相同組み換え修復(Homology-directed repair: HDR)は、分裂する細胞の細胞周期S/G2期にのみ生じ、心筋細胞を含む分裂しない細胞への応用は困難とされていました。我々は、心筋に特異的に発現するミオシン調節軽鎖タンパク質(Myl2遺伝子)の3’末端にtdTomato蛍光タンパク質をノックインする評価系を用いて、新生仔培養心筋細胞においてHDRが生じることを報告しましたが(Ishizu, T, et al. Sci Rep 7, 9363, 2017)、成獣心臓組織の心筋細胞においてHDRが生じるかは不明でした。
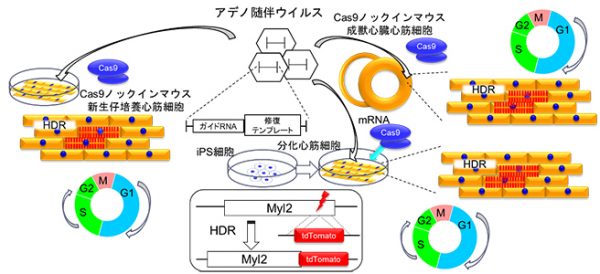
 今回我々は、Cas9ノックインマウスを用い、左室心筋組織へのアデノ随伴ウイルス(AAV)の直接注入を介して高コピー数の遺伝子導入を行うことにより、マウス成獣心臓組織においてHDRが生じることを見出しました(右図上)。DNAを2本鎖で導入するアデノウイルスを用いた場合、成獣心臓組織でのHDRは認められず、1本鎖DNA導入を介したSingle-strand template repairメカニズムが関与していることが示唆されました。
今回我々は、Cas9ノックインマウスを用い、左室心筋組織へのアデノ随伴ウイルス(AAV)の直接注入を介して高コピー数の遺伝子導入を行うことにより、マウス成獣心臓組織においてHDRが生じることを見出しました(右図上)。DNAを2本鎖で導入するアデノウイルスを用いた場合、成獣心臓組織でのHDRは認められず、1本鎖DNA導入を介したSingle-strand template repairメカニズムが関与していることが示唆されました。
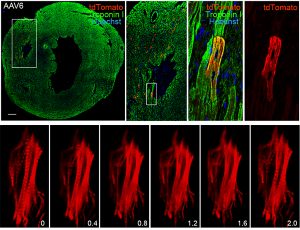
更にこの方法を応用し、ヒトiPS分化心筋細胞に対して、分化後にAAVによる遺伝子導入により直接HDRを生じさせ、拍動するサルコメア構造を可視化する系を確立しました(右図下)。心筋細胞におけるAAVを用いたHDRの誘導は、今後の循環器疾患研究に対して様々な応用が期待できると考えられます。