分子心臓病研究グループ
グループ概要
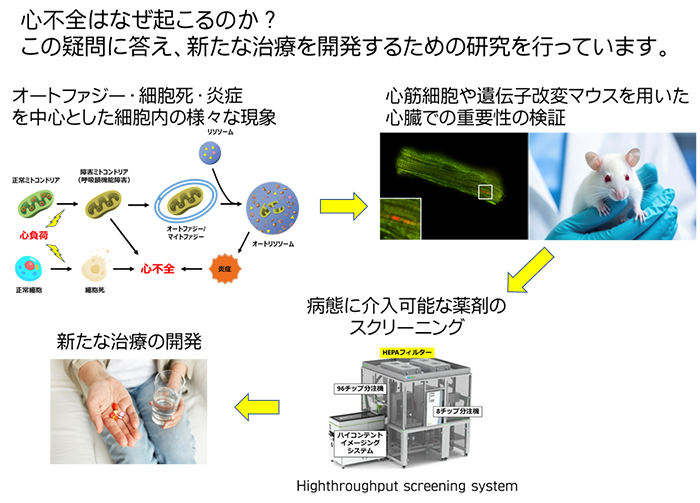
私たちは心不全を含めた心臓病態における、さまざまな生命現象に分子レベルからアプローチすることでその根幹に迫り、ひいては創薬に結びつく分子標的を同定することを目標としています。心不全に関わる機構としてアポトーシスやネクローシスなどの細胞死、オートファジーと呼ばれる細胞内分解経路、ならびに心臓における炎症などに着目して研究を行ってきました。そして、オートファジーの心臓における保護的役割や、心臓においてミトコンドリアDNAが無菌性炎症の原因となることを世界に先駆けて報告してきました(Nature Medicine 2007, Nature 2012)。その後もこれまでの研究成果との連続性をもってミトコンドリアやフェリチン選択的オートファジーに対する研究を行うとともに、収縮機能が保たれた心不全(HFpEF)の分子メカニズム解明などの新しいテーマにも取り組んでいます。国立循環器病センター・心不全病態制御部とも合同ミーティングを通して密接に連携しながらこれらの研究を進めています。今後は、我々が得たこれらの知見をいかにヒトへ適用していくかという点にも重きを置いて、さらに研究を発展させていきたいと考えています。
研究目的および内容
1. ミトコンドリアの融合・分裂が及び分解が心臓病態に及ぼす影響の検討
ミトコンドリアは融合と分裂によってその形を大きく変化させる動的なオルガネラです。その形態変化は傷害を受けたミトコンドリアのオートファジー性分解と強い関わりを持ちます。私たちはBcl2-L-13と呼ばれる分子が、ミトコンドリアの形態変化を誘導し、さらにミトコンドリア特異的なオートファジー(マイトファジー)の受容体として機能することを報告しました(Nat. Commun 2015)。その後も、Bcl2-L-13によるマイトファジー開始メカニズム(Cell Rep. 2019)やBcl2-L-13の心臓における保護的役割について報告しています(Cell Rep. 2024)。今後は、Bcl2-L-13の活性化メカニズムを詳細に解析し、心不全に対する創薬に繋げたいと考えています。
2. 収縮機能が保たれた心不全(HFpEF)モデルマウスの確立と分子機構の解明
近年、高齢化に伴いHFpEFは増加し、心不全患者の約半数を占めます。しかし、有効な薬剤は限定的であり、分子メカニズムの解明による新たな治療の確立が望まれます。我々は、独自にHFpEFのマウスモデルを確立し、これを用いてHFpEFの分子メカニズムの解明に挑んでいます。
3. 非アポトーシス性細胞死に関わる分子の心臓病態に於ける機能解析
心臓に対する圧負荷に反応して、カルシウム非依存性フォスフォリパーゼβ(iPLA2β)が細胞膜リン脂質を分解し、LysoPSという物質を産生し、LysoPSがG-protein coupled receptor 34(GPR34)を介してネクローシスという種類の細胞死を心筋細胞に誘導することが心不全の悪化に関与することを見出しました(Nat Commun 2023)。このiPLA2β-LysoPS-GPR34経路に着目し、今後も研究を進めていきます。
4. ミトコンドリアDNA分解不全が起点となるToll様受容体を介する炎症反応を標的とした新規心不全治療の開発
ミトコンドリアDNA分解不全を解消し、炎症反応を抑制するためにミトコンドリアDNAの分解酵素であるDNaseIIを活性化し、心不全を抑制可能な薬剤についてマウス心不全モデルを用いて実証実験を行っています。
5. フェリチノファジー及びフェロトーシスの薬物による制御
フェリチン特異的オートファジーであるフェリチノファジーが心不全の悪化に関与することを報告しており、フェリチノファジーを抑制可能な化合物について検討しています。
メンバー紹介
- 【ラボメンバー】
- 村川智一(助教)
- 西田博毅(医員)
- 峯健太朗(大学院生)
- 末谷悠人(大学院生)
- 松浦成咲(医学部保健学科)
- 杉原隆太(留学中)
- 【連携研究者】
- 大津欣也(国立循環器病研究センター・理事長)
- 山口 修(愛媛大学大学院医学系研究科・教授)
- 中山博之(循環器内科学・招聘准教授)
- 大宮茂幹(国立循環器病センター 心不全病態制御部・部長)
- 種池 学(奈良先端科学技術大学・教授)
主要論文
- AMPK regulates Bcl2-L-13-mediated mitophagy induction for cardioprotection.
Murakawa T, et al. Cell Rep. 2024, 43, 115001-115001 - Lysophosphatidylserine induces necrosis in pressure overloaded male mouse hearts via G protein coupled receptor 34. Sugihara R, et al. Nat Commun. 2023, 14, 4494-4494
- Rubicon-regulated beta-1 adrenergic receptor recycling protects the heart from pressure overload. Akazawa Y, et al. Sci Rep. 2022 7;12(1):41.
- Iron derived from autophagy-mediated ferritin degradation induces cardiomyocyte death and heart failure in mice. Ito J, et al. Elife. 2021;10:e62174.
- Comprehensive autophagy evaluation in cardiac disease models. Kaludercic N, et al.
Cardiovasc Res. 2020;116(3):483-504. - Cytokine mRNA Degradation in Cardiomyocytes Restrains Sterile Inflammation in Pressure-Overloaded Hearts. Omiya S, et al. Circulation. 2020;141(8):667-677.
- Administration of a TLR9 inhibitor attenuates the development and progression of heart failure in mice. Ueda H, et al. JACC Basic Transl Sci. 2019;4:348-363.
- A Mammalian Mitophagy Receptor, Bcl2-L-13, Recruits the ULK1 Complex to Induce Mitophagy. Murakawa T, et al. Cell Rep. 2019;26:338-45.
- mTOR Hyperactivation by Ablation of Tuberous Sclerosis Complex 2 in the Mouse Heart Induces Cardiac Dysfunction with the Increased Number of Small Mitochondria Mediated through the Down-Regulation of Autophagy. Taneike M, et al. PLoS ONE 2016;11:e0152628
- Bcl-2-like protein 13 is a mammalian Atg32 homologue that mediates mitophagy and mitochondrial fragmentation. Murakawa T, et al. Nat Commun. 2015;6:7527
- Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure. Oka T, et al. Nature. 2012;485:251-5
- Inhibition of autophagy in the heart induces age-related cardiomyopathy.
Taneike M, et al. Autophagy. 2010;6:600-6 - The role of autophagy in cardiomyocytes in the basal state and in response to hemodynamic stress. Nakai A, et al. Nat Med. 2007;13:619-24






