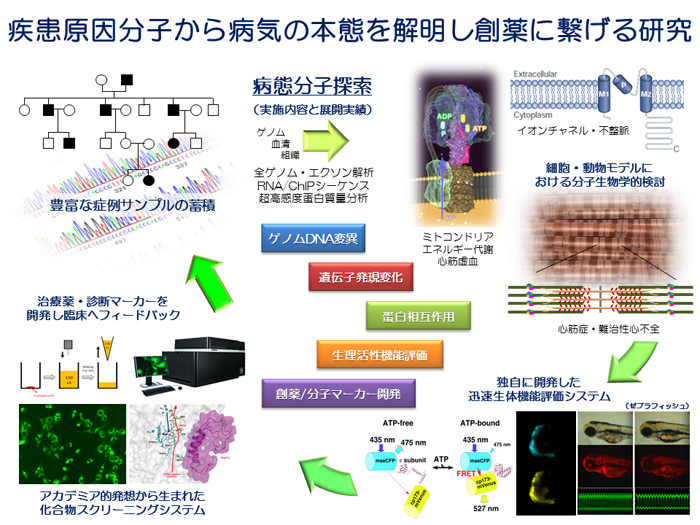
病態分子探索グループ
分子情報に基づく病態理解、発症診断、予後予測、発症予防、そして疾患治療に対する最先端の技術開発は、「ゲノム医療」という新たな医療を提供します。我々はゲノム・オミックスを含めた情報解析、分子生物学的基盤技術、臨床診断、新規治療法、以上4つの開発項目について、「探る」・「獲る」・「測る」・「観る」・「創る」の5つの視点から取り組んでいます。
グループ概要
ゲノム・オミックス情報の高精細・網羅的な情報抽出と病態へのかかわりを探索し、Precision Medicine(精密医療)を可能にするため、最新バイオインフォマティクス解析技術の応用、ゲノム解析・臨床遺伝子診断法の開発、ゲノム情報に基づく新しい疾患層別化、病態機序解明、そして創薬・遺伝子治療など新規治療法の開発研究などを行っています。
「如何に小さな生化学的事実であっても必ず生命現象に反映される。だから臨床から得られた試料をもとに探索同定された分子を生体構成の機能単位である蛋白レベルで解析することが重要である。得られた生命科学の真実は必ず臨床に還元される」と考え、臨床・基礎循環型の研究テーマに取り組んでいます。
研究目的および内容
- 難治性遺伝性心筋症・不整脈の疾患ゲノム解析による未知なる分子機序解明と創薬開発研究
全ゲノム・全エクソン解析を行う多施設共同の解析研究拠点事務局として活動するとともに、心筋症・不整脈の難病原因遺伝子のゲノム解析から、分子病態解明、生体機能解析、診断マーカー、分子標的治療法(創薬・治験実施、遺伝子治療ベクター開発)の研究開発をおこない、ゲノム医療の実現を目指した研究を行っています。 - In vivo imagingを用いた心筋エネルギー代謝・収縮制御機構の解明、心筋細胞恒常性維持機構解明
心筋細胞はほとんど分裂することも無く、生涯にわたり収縮・拡張を繰り返し続ける極めて特殊な細胞と言えると思います。我々は、なぜ心筋細胞はそのようなことが可能なのか?という素朴な疑問に正面から挑戦することが、心疾患の克服に繋がると考え、特にエネルギー代謝と心筋細胞独自の微細構造に着目して研究を進めています。新たな発見には新たな技術の確立が必須と考え、蛍光蛋白質を用いた生体内エネルギー代謝イメージングに加え、MRIを用いた代謝分子イメージングを確立しました。またT管/筋小胞体により形成される微小構造が心筋細胞恒常性維持に関与していることを突き止め、現在は心筋細胞の微小構造維持機構と代謝恒常性維持の分子レベルでの理解を目指しています。 - 心臓エピゲノム制御機構と心不全の可逆・不可逆性の分子機序の解明
心不全の代表的なマーカーであるBNPはどのように分泌制御されているのでしょうか。不全心筋とは何でしょうか。もっと言えば心不全とは何でしょうか。こうした疑問を一つ一つ解明するために我々が着目したのはエピゲノム分子制御です。我々はBNPの発現を調節する領域(エンハンサー領域)を発見しました。さらにそのエンハンサー領域がどのようなストレスで活性化されるのか、どのような転写因子でコントロールされるのかについても解明いたしました。心不全の早期発見を可能とする分子指標開発やBNP制御による心不全治療の研究などへ幅広く展開してまいります。 - ゲノム解析・バイオインフォマティクス解析による横断オミックス、人工知能・AI研究
AIの技術は自動運転だけでなく循環器内科領域の研究にも深くかかわっています。一般に機械学習や人工知能といった技術にはBig dataが必要と言われておりますが、症例数の少ない遺伝性心筋症などの希少難病を層別化し個別の精密医療(Precision medicine)を提供できるよう研究を進めています。具体的にはゲノム配列から変異を見つけ(Re-seq解析)、その変異による遺伝子発現の変化を捉え(RNA-seq解析)、エピゲノム分子制御も考慮し(ChIP-seqなど)、組織中の代謝物などの情報も組み合わせることで多方面から病態に迫る横断オミックスという手法を展開しています。さらに全国の大学や病院と連携しながら症例を増やしより精度の高い遺伝的な診断が出来るよう体制を整えています
メンバー紹介
- 【グループメンバー】
- 木岡秀隆(助教)
- 西村俊亮(大学院生)
- 田邊和也(大学院生)
- 木村鎬成(大学院生)
- 李 方方(大学院生)
- 井戸允清(大学院生)
- 佐々木駿(大学院生)
- 山田憲明(国際共創大学院学位プログラム推進機構・特任助教)
- 瀬川貴嗣(医化学/循環器内科学・大学院生)
- 【未診断疾患イニシアチブIRUD解析センター】
- 永田美保(特任研究員)
- 【共同・連携研究者】
- 高島成二(医化学・教授)
- 松岡 研(医化学・准教授)
- 加藤久和(医化学・助教)
- 朝野仁裕(国立循環器病研究センター・ゲノム医療部・ゲノム医療支援部長)
- 宮下洋平(国立循環器病研究センター ゲノム医療支援部 遺伝情報管理室・室長)
- 藏本勇希 (国立循環器病研究センター・心不全病態制御部・上級研究員)
- 四宮春輝(国立循環器病研究センター 病態ゲノム医学部 上級研究員(ゲノム医療支援部併任))
主要論文
- Nishimura S, et. al. HSC70 coordinates COP9 signalosome and SCF ubiquitin ligase activity to enable a prompt stress response. EMBO Rep. 2025
- Yamamoto H et.al, Human leukocyte antigen-DQ risk heterodimeric haplotypes of left ventricular dysfunction in cardiac sarcoidosis: an autoimmune view of its role. Sci Rep. 2023
- Hakui H, et al. Refractory Ventricular Arrhythmias in a Patient With Dilated Cardiomyopathy Caused by a Nonsense Mutation in BAG5. Circ J. 2022
- Hakui H, et al. Loss-of-function mutations in the co-chaperone protein BAG5 cause dilated cardiomyopathy requiring heart transplantation. Sci Transl Med. 2022.
- Shinomiya H, et al. Aberrant accumulation of TMEM43 accompanied by perturbed transmural gene expression in arrhythmogenic cardiomyopathy. FASEB J. 2021
- Takahashi Y, et al. Visualization of Spatial Distribution of Spermatogenesis in Mouse Testes Using Creatine Chemical Exchange Saturation Transfer Imaging J Magn Reson Imaging. 2021.
- Takahashi Y, et al. Accurate Estimation of the Duration of Testicular Ischemia Using Creatine Chemical Exchange Saturation Transfer (CrCEST) Imaging. J Magn Reson Imaging. 2021.
- Miyashita Y, et al. The CR9 element is a novel mechanical load‐responsive enhancer that regulates natriuretic peptide genes expression. FASEB J.2021.
- Kioka H, et al. In Vivo Real-Time ATP Imaging in Zebrafish Hearts Reveals G0s2 Induces Ischemic Tolerance. FASEB J. 2020.
- Takahashi Y, et al. Mouse Skeletal Muscle Creatine Chemical Exchange Saturation Transfer (CrCEST) Imaging at 11.7T MRI. J Magn Reson Imaging. 2020.
- Yamada N, et al. Mutant KCNJ3 and KCNJ5 Potassium Channels as Novel Molecular Targets in Bradyarrhythmias and Atrial Fibrillation. Circulation. 2019.
- Takahashi Y, et al. Detection of Increased Intracerebral Lactate in a Mouse Model of Leigh Syndrome Using Proton MR Spectroscopy. J Magn Reson Imaging. 2019.
- Asano Y. How to Eliminate Uncertainty in Clinical Medicine – Clues from Creation of Mathematical Models Followed by Scientific Data Mining. EBioMedicine. 2018.
- Kanzaki M, et al. A Development of Nucleic Chromatin Measurements as a New Prognostic Marker for Severe Chronic Heart Failure. PLOS ONE. 2016.
- Yan Y, et al. Augmented AMPK activity inhibits cell migration by phosphorylating the novel substrate Pdlim5. Nat Commun. 2015.
- Hayashi T, et al. Higd1a is a positive regulator of cytochrome c oxidase. Proc. Natl. Acad. Sci. USA. 2015.
- Kioka H, et al. Evaluation of intra-mitochondrial ATP levels identifies G0/G1 switch gene 2 as a positive regulator of oxidative phosphorylation. Proc. Natl. Acad. Sci. USA. 2014.
- Matsuoka K, et al. Noninvasive and quantitative live imaging reveals a potential stress-responsive enhancer in the failing heart. FASEB J. 2014.
- Shintani Y, et al. TLR9 mediates cellular protection by modulating energy metabolism in cardiomyocytes and neurons. Proc Natl Acad Sci U S A.2013.
- Nakano A, et al. AMPK controls the speed of microtubule polymerization and directional cell migration through CLIP-170 phosphorylation. Nature Cell Biology. 2010.
- Higo S, et al. Isoform-specific intermolecular disulfide bond formation of heterochromatin protein 1 (HP1). J Biol Chem. 2010.
- Seguchi O, et al. A cardiac myosin light chain kinase regulates sarcomere assembly in the vertebrate heart. J Clin Invest. 2007.
- Shintani Y, et al. Glycosaminoglycan modification of neuropilin-1 modulates VEGFR2 signaling. EMBO J. 2006.
- Asano Y, et al. Lamr1 functional retroposon causes right ventricular dysplasia in mice. Nature Genetics. 2004.
- Takashima S, et al. Heparin-binding EGF-like growth factor and ErbB signaling is essential for heart function. Proc Natl Acad Sci U S A. 2003.
- Yamazaki S, et al. Mice with defects in HB-EGF ectodomain shedding show severe developmental abnormalities. J Cell Biol. 2003.
- Takashima S, et al. Targeting of both mouse neuropilin-1 and neuropilin-2 genes severely impairs developmental yolk sac and embryonic angiogenesis. Proc Natl Acad Sci U S A. 2002.
- Asakura M, et al. Cardiac hypertrophy is inhibited by antagonism of ADAM12 processing of HB-EGF: Metalloproteinase inhibitors as a new therapy. Nature Medicine 2002.
- Soker S, Takashima S, et al. Neuropilin-1 is expressed by endothelial and tumor cells as an isoform- specific receptor for vascular endothelial growth factor. Cell 1998.